ZC1105 Real-time PCR QPCR
 实验收费标准:
实验收费标准:
| 项目编号 | 项目名称 | 计价单位 | 单价 |
| ZC1105 | Real-time PCR | 个 | 100元 |
 实验流程:
实验流程:
荧光定量PCR实验步骤:
1、总RNA抽提(枪头和离心管均经过湿热灭菌,无RNA酶)
①取匀浆器,加入1ml的Trizol Reagent,置冰上预冷。
②取100mg组织,加入到匀浆器中。
③充分研磨直至无可见组织块。
④13000g离心10min取上清。
⑤加入250 μl,颠倒离心管15s,充分混匀,静置3min。
⑥4℃下13000g离心8min。
⑦将上清转移到一新的离心管中,加入0.8倍体积的异丙醇,颠倒混匀。
⑧-20℃放置15min。
⑨4℃下13000g离心10min,管底的白色沉淀即为RNA。
⑩吸除液体,加入75%乙醇1.5ml洗涤沉淀。
⑪4℃下13000g离心5min。
⑫将液体吸除干净,将离心管置于超净台上吹3min。
⑬加入20μl无RNA酶的水溶解RNA。
⑭55℃孵育5min。
2、反转录(枪头和PCR均经过湿热灭菌,无RNA酶)
①取一PCR管,加入含2μg RNA的溶液。
②加入1μl oligo(dT)15。
③用无核糖核酸酶的去离子水补足至12μl。
④于PCR仪上70℃保温5min,迅速置冰上冷却。
⑤依次加入4μl 5×buffer,2μl 10mM dNTPs,1μl RNA inhibitor和1μl 反转录酶,用枪抽吸混匀。
⑥于PCR仪上42℃保温60min,结束后80℃保温5min灭活反转录酶。
3、定量PCR1)取0.2ml PCR管,配制如下反应体系,每个反转录产物配制3管。2× qPCR Mix 12.5μl7.5μM基因引物 2.0μl反转录产物 2.5μlddH2O 8.0μl2)取0.2ml PCR管,配制如下反应体系,每个反转录产物配制3管。2×qPCR Mix 12.5μl7.5μM内参引物 2.0μl反转录产物 2.5μlddH2O 8.0μl3)PCR扩增预变性 95℃,10min循环(40次) 95℃,15s→60℃,60s溶解曲线 75℃→95℃,每20s升温1℃4、结果处理ΔΔCT法:A=CT(目的基因,待测样本)- CT(内标基因,待测样本)B=CT(目的基因,对照样本)- CT(内标基因,对照样本)K=A-B表达倍数=2-K
 送样运输要求:
送样运输要求:
1. 样品处理
a) 动物组织:常规组织100mg,脂肪组织,结缔组织,纤维化组织适当增加。将组织剪切成合适大小后(建议组织块长宽高均不大于0.5 cm),然后迅速完全浸泡于5~10倍体积的RNAsolidTM试剂中。(注意:已浸入RNAsolidTM试剂中的组织经平衡一段时间后,可从溶液中取出,切成更小的组织块,再重新放回RNAsolidTM试剂中;有些比较弱的液体渗透性组织如骨头等,不适合用RNAsolidTM试剂进行RNA保护。)
b) 植物组织:新鲜的叶、果肉、种子最少100 mg。将嫩叶,嫩茎组织切成合适的大小(建议长宽高均不大于0.5 cm)后,然后迅速完全浸泡于5~10倍体积的RNAsolidTM试剂中。(注意:某些植物组织天生具有的屏障,如叶子表面的蜡层可阻碍RNAsolidTM试剂的渗透,对于此类组织,通常需破坏这些屏障层以允许溶液的浸透。)
c) 细胞等样本:收集不少于10^6个细胞沉淀(用PBS清洗1-2次),干冰运输。
d) 酵母、细菌等样本:离心弃上清,收集一定量的菌体沉淀,干冰运输。
e)全血:最少1 mL新鲜血液EDTA抗凝管,干冰运输。
f)血清或血浆:最少1 mL,干冰运输。
g) RNA样品: OD260/280为1.8-2.0,浓度≥100 ng/μL,体积≥20μL,干冰运输。
h)cDNA:cDNA原液≥20 μL,干冰运输。
2. 样品保存及运输
加入有RNAsolidTM试剂的样本可在37℃保存1~2天,2天以后部分组织中的RNA会开始降解。室温(25℃)稳定保存1周,不会有明显的RNA降解发生。大部分样品置于RNAsolidTM试剂中,4℃条件下可稳定保存1个月,不会有明显的RNA降解发生。长期存放可先将保存在RNAsolidTM试剂中的样本4℃浸透过夜,然后将RNAsolidTM试剂吸出弃去,再将样本放入-20℃或-80℃长期稳定保存3~5年。
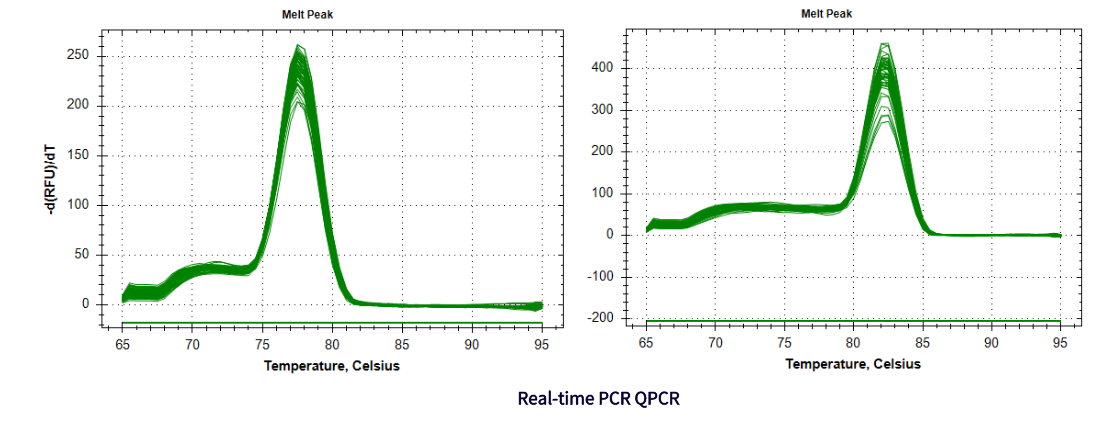
 实验结果展示:
实验结果展示:
 外包服务流程:
外包服务流程:



 销售咨询
销售咨询